PACS 31; 32.30.Rj
УДК 539.26
А.Т. Серков, А.А. Серков
ООО НИЦ (Научно-инженерный центр) “Углехимволокно”
Аннотация.
На примере элементов восьмой группы (инертные газы) показано, что спектр частот излучения ν химических элементов выражается графиком функции ν = К/r1,5, где r орбитальный радиус атома, а коэффициент пропорциональности К зависит от корня квадратного из атомной массы. По минимальным значениям частот излучения определены атомные радиусы, которые совпадают со справочными данными.
Частоты излучения и потенциалы ионизации элементов восьмой группы (инертные газы) хорошо изучены.[1, 2]. Однако отсутствует привязка этих величин к орбитальным радиусам атомов, которые определяют процесс излучения и ионизации. Ранее [3] нами получена эмпирическая формула, связывающая частоту излучения, атомную массу элемента и орбитальный радиус в виде:
|
ν = сm0,5/fr1,5, |
(1) |
где ν- частота излучения, с- скорость света, m- атомная масса, f- константа, равная 0,1076.1010 г0,5см-0,5, r- орбитальный радиус. Формула апробирована при расчёте атомных радиусов щелочных металлов [4]. В данной работе рассматривается связь между орбитальными радиусами атомов инертных газов с одной стороны и частотами излучения и потенциалами ионизации с другой.

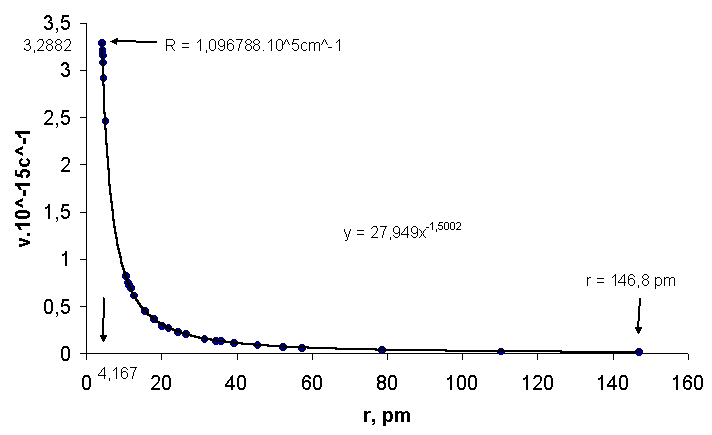
Рис.1. Зависимость частоты излучения от радиуса атома водорода:
3,2882.1015
с-1 - предельная частота ν∞ в серии Лаймана, 4,167 пм радиус реализации предельной частоты, R = 1,096788 см-1 постоянная Ридберга, 27,949 - коэффициент пропорциональности кривой ν = f(r), r =146,8 пм- атомный радиус водорода.Для установления связи с ранее полученными данными на рис.1 представлена кривая зависимости ν от
r, рассчитанная по формуле (1), для простейшего атома водорода. Энергия ионизации водорода, выраженная через частоту, равна ν = 3,2883.1015 с-1 или 1,09679.105 см-1. В соответствии с уравнением Ридберга-Бальмера:|
ν = сR(1/ni2 - 1/nj2), |
(2) |
где
ν- частота излучения, с- скорость света, ni и nj- квантовые числа, предельное значение частоты в серии излучения Лаймана, численно равно постоянной Ридберга, выраженной через частоту. В самом деле, при ni = 1 и nj= ∞ предельная частота ν∞ = сR, то есть постоянная Ридберга R равна предельной частоте, выраженной в волновых числах (обратных см-1):|
R = ν∞/c, |
(3) |
и следовательно энергии ионизации 3,2882.10
:15 c-1. На кривой зависимости ν от r (см.рис. 1) эта частота есть крайняя точка слева при r = 4,167 пм. Можно предположить, что такая закономерность имеет общий характер и на кривых ν = f(r) для инертных газов крайняя левая точка будет выражать постоянную для данного элемента величину, аналогичную константе Ридберга для водорода.Решая совместно уравнения (1) и (3), можно получить выражение постоянной Ридберга через атомную массу и орбитальный радиус соответствующей частоты излучения:
|
R = m0,5/fr∞, |
(4) |
В таблице 1 в столбцах 1 и 2 приведены обозначения элементов и их атомные массы. В столбцах 3 и 4 даются первые энергии ионизации, причём в столбце 4 энергия ионизации выражена через частоту, которая, как отмечалось выше, численно совпадает с предельной частотой ν
∞. По предельной частоте (первой энергии ионизации) рассчитывали соответствующий ей предельный радиус r∞, который затем использовали для расчёта константы R по уравнению (4).Таблица 1. Расчёт константы Ридберга
R, коэффициента пропорциональности К и атомных радиусов для водорода и инертных газов|
Эле мент |
m ,даль тон |
I |
r ∞.1010, пм |
R .10-5 см-1 |
K ,см 1,5с-1 |
r a.1010, пм |
||
|
эВ |
ν ∞.10-15, с-1 |
(3) |
(4) |
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
H |
1,008 |
13,597 |
3,2883 |
4,167 |
1,09677 |
1,09683 |
27,971 |
146,8 |
|
He |
4,003 |
24,586 |
5,9453 |
4,447 |
1,98305 |
1,98309 |
55,753 |
53,65 |
|
Ne |
20,18 |
21,564 |
5,2151 |
8,321 |
1,73926 |
1,73953 |
125,16 |
102,7 |
|
Ar |
39,95 |
15,759 |
3,8112 |
12,88 |
1,27119 |
1,27125 |
176,10 |
131,5 |
|
Kr |
83,90 |
13,999 |
3,3855 |
17,84 |
1,12915 |
1,12925 |
255,06 |
166,4 |
|
Xe |
131,3 |
12,129 |
2,9333 |
22,80 |
0,97840 |
0,97842 |
319,27 |
199,8 |
|
Rn |
222,0 |
10,745 |
2,5996 |
29,44 |
0,86703 |
0,86711 |
415,16 |
- |
Для проверки принципа соответствия необходимо подтвердить идентичность частот, рассчитываемых по формулам (1) и (2). Это достигается путём расчёта константы Ридберга
R для водорода по формулам (3) и (4). Первая из них классическая формула Ридберга-Бальмера. Она даёт известную константу Ридберга R. Вторая вытекает из полученной нами ранее [3] эмпирической формулы и связывает константу Ридберга R с атомной массой и орбитальным радиусом. Как видно из таблицы 1, формула (4) даёт с высокой точностью то же значение константы Ридберга R для водорода. Это позволяет сделать вывод, что принцип соответствия при выводе формулы (4) соблюдён и что эта формула может использоваться также для расчёта константы R для других элементов. Это предположение полностью подтверждается. В столбцах 6 и 7 приведены результаты расчёта константы R для всех элементов восьмой группы по формулам (3) и (4). Полученные результаты практически совпадают. Так например, для гелия по формуле Ридберга-Бальмера величина R = 1,98305.105, а по предложенной формуле 1,98309.105 см-1. В других случаях различие между величинами также наблюдается только в 4-5 знаке.На рис. 2, 3, 4, 5, 6 и 7 (см. в конце статьи) представлены кривые зависимости частот излучения от радиуса атома для гелия, неона, аргона, криптона, ксенона и радона. Во всех случаях зависимости с высокой точностью выражаются степенной функцией:
|
ν = Кr-1,5, |
(5) |
где коэффициент пропорциональности К, имеющий размерность см
1,5с-1, является индивидуальной характеристикой элемента. Он зависит от атомной массы и выражается формулой:|
К = сm05/f, |
(6) |
где с- скорость света,
m- атомная масса и r- радиус . Величина К для Не равна 55,75 и растёт по мере увеличения молекулярной массы до 415,16 у радона. Значения коэффициентов пропорциональности, рассчитанные по уравнению (6) практически совпадают с компьютерными величинами, получаемыми при построении графиков по справочным значениям частот. Так например, расчёт по формуле (6) дал величины константы К: Не- 55,75, Ne- 125,16, Ar- 176,10. По справочным частотам получены соответственно близкие значения: 55,81; 125,21 и 176,16, см. надписи на рисунках.По ранее описанному спектроскопическому методу [4] рассчитывали атомные радиусы инертных газов. С этой целью определяли минимальную частоту излучения элемента и по уравнению (1) устанавливали соответствующий этой частоте радиус. На рисунках эти частоты и радиусы отмечены стрелками. Полученные значения радиусов представлены в таблице 1 в столбце 9. Они хорошо согласуются с литературными данными.
Таким образом, спектр излучения химического элемента можно охарактеризовать по трём элементам графика функции зависимости частоты от радиуса атома ν
= Кr-1,5:- начальной точке кривой, выражающей предельную частоту или постоянную Ридберга и численно равную первой энергии ионизации,
- коэффициенту пропорциональности, зависящему от атомной массы элемента и
- минимальной частоте, позволяющей оценивать радиус атома элемента.
Выводы
1. На основе изучения зависимости частот излучения ν водорода и элементов восьмой группы (инертные газы) таблицы Менделеева от атомной массы и радиуса атомов
r можно полагать, что спектр излучения химических элементов описывается графиком функции ν = К/r1,5. Начальная точка в этом графике выражает предельную частоту и количественно равна первой энергии ионизации и постоянной Ридберга. Коэффициент пропорциональности этой функции К зависит от корня квадратного из атомной массы элемента.2. Получено уравнение для расчёта константы Ридберга по атомной массе и орбитальному радиусу. Рассчитанная по этому уравнению константа Ридберга для атома водорода совпадает с константой Ридберга, рассчитываемой по уравнению Ридберга-Бальмера, что подтверждает соблюдение принципа соответствия при выводе новой формулы.
3. Рассчитаны атомные радиусы инертных (благородных) газов, которые удовлетворительно согласуются со значениями, приводимыми в справочной литературе.
Литература
1. Г. А.Одинцова, А.Р. Стриганов, Таблицы спектральных линий нейтральных и ионизованных атомов.. М., Энергоиздат., 1982.
2. NIST, Atomic Spectroscopy group, http://www.nist.gov/pml/div684/grp01/index.cfm
3. А.Т. Серков, А.А. Серков, “Зависимость длины волны характеристического рентгеновского излучения химических элементов от их атомных радиусов и масс”, направлена в ЖЭТФ 28.11.2009г.
4. А.Т. Серков, А.А. Серков, “Радиусы атомов водорода и щелочных элементов”, статья отправлена в ЖЭТФ 07.02.11г.
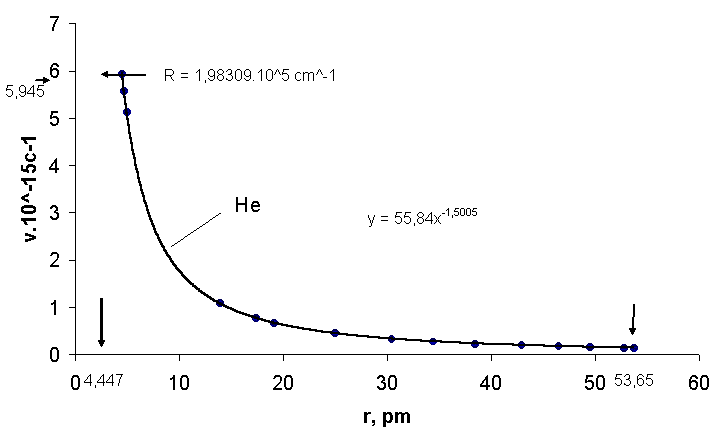
Рис.2.Зависимость частоты излучения ν от радиуса атома гелия
r: 5,9450- предельная частота ν∞, реализуемая при радиусе 4,447 пм; 55,84- коэффициент пропорциональности; 53,65 пм- атомный радиус гелия.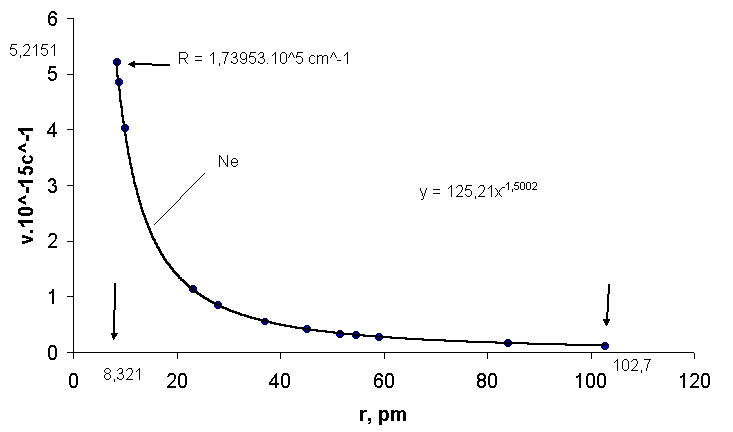
Рис.3. Зависимость частоты излучения неона ν от радиуса атома
r: 5,2151.1015 с-1 – предельная частота ν∞ излучения при радиусе 8,321 пм: 125,21- коэффициент пропорциональности; 102,7- атомный радиус неона.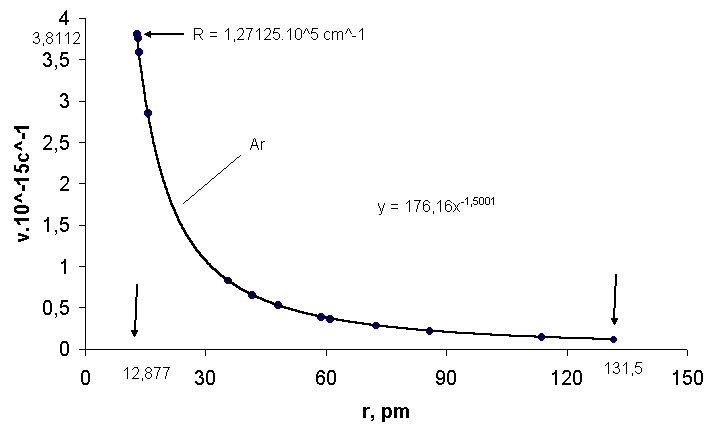
Рис.4. Зависимость частоты излучения аргона ν от радиуса атома
r: 3,8112.1015 с-1 – частота ν∞ при r = 12,877 пм; 176,16- коэффициент пропорциональности; 131,5 пм- атомный радиус аргона.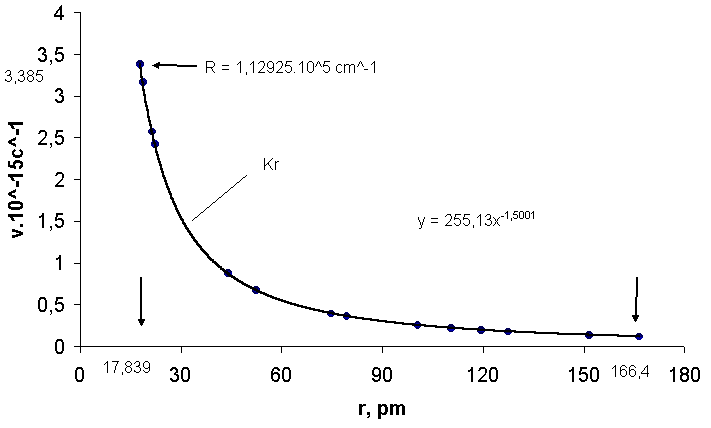
Рис. 5.Зависимость частоты излучения криптона ν от радиуса атома
r: 3,3850.1015 с-1 предельная частота ν∞ при радиусе 17,839 пм; 255,13 – коэффициент пропорциональности; 166,4пм- атомный радиус криптона.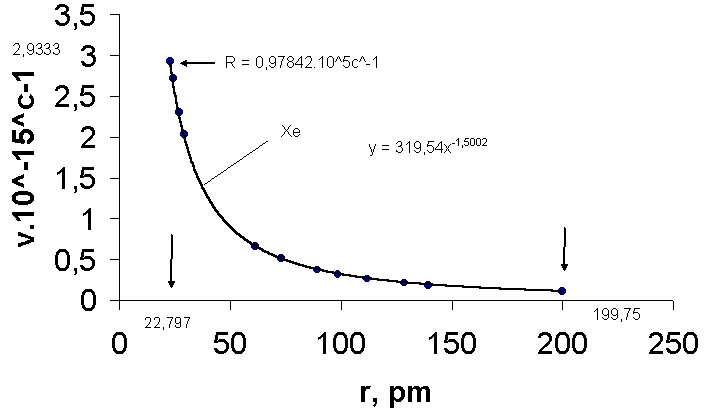
Рис.6.Зависимость частоты излучения ксенона ν от радиуса атома
r: 2,9333.1015 с-1предельная частота ν∞, реализуемая при радиусе 22,787 пм; 319,54- коэффициент пропорциональности; 199,75 пм- атомный радиус ксенона.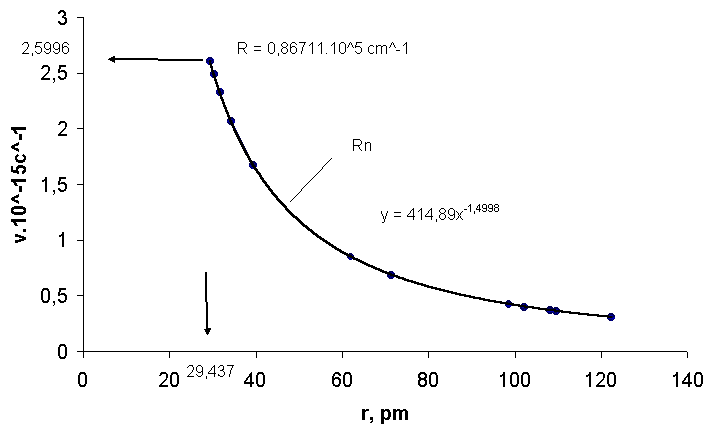
Рис.7.Зависимость частоты излучения радона ν от радиуса атома
r:2,5996.1015 с-1 предельная частота ν∞ при радиусе 29,437 пм; 414,89- коэффициент пропорциональности