Abb. 1. Das Avameiz
Johann Kern
Kausale Deutung der Strahlungsspektren der Gase
Aufgrund einer anderen Annahme, als seiner Zeit Rutherford [1] gemacht hat, wird ein anderes Atommodell aufgebaut, daß im Vergleich mit dem Bohr´schen Atommodell viel mehr der Wirklichkeit entspricht. Wird gezeigt, daß die sogenannten „Atomspektren“ in Wirklichkeit von Gruppierungen der neutralen Atomen um ein Ion ausgestrahlt werden. Die Beträge der Strahlungsportionen (Quanten) werden nicht vom Aufbau der Atome, sondern von räumlicher Ordnung dieser Atomansammlungen bedingt.
Die Lage in der modernen Atomtheorie ist sehr ähnlich der Lage in der Astronomie vor Kopernikus (1473-1543) und Newton (1643-1727). Astronomen konnten viele Jahre im voraus die sichtbare Lage der Planeten berechnen, hatten aber keine einfache Erklärung, warum die Planeten sich in bestimmten Zeitabständen in andere Richtung bewegen. Damals wurde die Erde für das Zentrum des Universums gehalten, um sie drehten sich angeblich die Sonne und die Planeten. Im Unterschied zu dieser „heiligen Theorie“ nahm Kopernikus „lästernd“ die Sonne zum Zentrum des Universums und erklärte, daß die Erde den üblichen bekannten Planeten ähnlich ist. Dies unterstützte das Verstehen, daß alle Planeten sich in Wirklichkeit immer in eine Richtung bewegen müssen. Die Bewegung in andere Richtung konnte man jetzt als scheinbare Bewegung erklären. Aber die Idee von Kopernikus konnte immer noch nicht die periodische Beschleunigung und Verlangsamung der Planeten darstellen. Nur aufgrund der Gravitationstheorie konnte Newton eine richtige, einfache und kausale Erklärung der Bewegung der Planeten geben. Für die Beschreibung des Universums brauchte man nicht mehr die Idee der übernatürlichen Kräfte.
Genau wie damals das Ptolemäische System, rein mathematisch gesehen, fühlt sich das moderne Atommodell ganz wohl. Man kann alles berechnen und erklären. Fast alles. Man benimmt sich aber wie ein Eisläufer auf dünnem Eis. Alle gefährliche Plätze werden sorgfältig in bestimmten Abstand passiert. Es ist klar, daß ein Elektron sich direkt in Richtung eines Atomkerns bewegen kann mit folgendem unvermeidlichen Zusammenstoß. Diese Möglichkeit (ganz zu schweigen von dem Wert der Wahrscheinlichkeit eines solchen Ereignisses) wird diplomatisch nie erwähnt. Das Bohratom kann eine langwellige Strahlung nur dann produzieren, wenn es schon heftig angeregt ist. Anders gesagt, nach der Theorie von Niels Bohr (1885-1962) kann ein Gas nur dann Wärmewellen ausstrahlen, wenn viele seine Atome in hochangeregtem Zustand sind, und, folglich, auch immer kurzwellige, unter anderem, Lichtausstrahlung zu erwarten ist. Kaltes Gas strahlt ständig Wärmewellen aus, aber noch keiner hat gesehen, daß es auch Lichtwellen ausstrahlt. Auch über das wird aus rein diplomatischen Gründen kein Sterbenswörtchen verloren. Man könnte sagen: Es gibt keine Theorie, die alles erklären kann. Der wichtigste Nachteil dieser Theorie aber, der nicht beseitigt werden kann, besteht in dem, daß fast alle Prozessen in der „Quantenmechanik“ keinen kausalen Zusammenhang haben. Das Atom strahlt Energie aus, wann es will. Keiner weis warum und keiner weis wie. Keiner weis, warum das Photon (eine Portion der elektromagnetischen Energie und gleichzeitig – elektromagnetische Welle), ausgestrahlt von einem Atom, Milliarden von Lichtjahren seine Form, Frequenz und Energie aufrecht erhält, während alle andere Wellen, die innerhalb eines winzigen Volumen entstanden sind, sehr schnell im Raum zerstreut werden und schon in kleiner Entfernung vom Entstehungsort fast nicht mehr bemerkbar sind.
Alles, was in der Quantenmechanik vorgeht, wird mit Hilfe von Quanten-Zahlen (!!!) und mit aus der Luft gegriffenen „Prinzipen“ [2] erklärt. Ein wahres Lehrbuch der Magie und Zauberei! Ein Zauberer; der Erfolg hat, wird bald Lehrlinge haben. Kein Wunder, daß Chemiker, die ja auch „wissenschaftliche Erfolge“ gebrauchen können, bei Versuchen die Symmetrie einiger Moleküle zu erklären, sich bis zur „Resonanz der Formeln“ [3] versteigen, einer Resonanz von Zeichengruppen, die sich nicht in der Reagenzretorte, sondern außerhalb auf einem Papierblatt befinden!
Zur Realität zurückzukehren kann nur ein Atommodell verhelfen, in dem alle Geschehnisse einen kausalen Zusammenhang haben. Es ist klar, daß dieses Modell in erster Reihe eine kausale Erklärung des Entstehen der „Atomspektren“ liefern muß, deren „erfolgreiche“ nicht kausale Erklärung [4] die Physiker des vorigen Jahrhunderts in einen kabbalistischen Labyrinth verirren lies.
1911 hat Rutherford (1871-1937) experimentell nachgewiesen, daß das Atom einen sehr kleinen, im Vergleich mit dem gesamten Volumen des Atoms, positiv geladenen Atomkern besitzt [1]. Der zweite Bestandteil des Atoms, das Elektron, ist auch winzig klein. Einen ähnlichen Beispiel haben wir schon in der Natur – das Planetensystem mit einem Stern im Zentrum. Hier wird das große Volumen des Systems durch die Kreisbewegung der (leichten) Planeten um den (schweren) Stern im großen Abstand von ihm erreicht. Bei der Kreisbewegung der Planeten wird die Anziehungskraft des Sterns durch die Fliehkraft des Planeten ausgeglichen. Darum befinden sich die Planeten im dynamischen Gleichgewicht und fallen nicht auf den Stern herab. Auch die negativ geladenen (leichten) Elektronen werden von dem positiv geladenen (schweren) Atomkern angezogen. Ganz von selbst drängt sich der Gedanke auf, daß vielleicht auch in diesem Fall die Elektronen um den Atomkern kreisen. Diesem hindert nur die bekannte Tatsache, daß das Elektron beim Kreisen Energie ausstrahlen muß. Darum müssen die Kreise immer kleiner werden und das Elektron muß (sehr schnell) auf das Atomkern niederstürzen. Das Elektron stürzt aber nicht ab. Daraus folgerte Rutherford das scheinbar einzig mögliche: Wenn das Elektron nicht abstürzt, bedeutet das, daß es beim Kreisen um das Atomkern keine Energie verliert.
Das war aber die einzig mögliche Folgerung nicht. Genausogut konnte man behaupten: Wenn das Elektron nicht abstürzt, bedeutet das, daß es (im Mikrobereich) eine Kraft gibt, die das verhindert. Mehr traditionell und mehr eindeutig kann man diesen Gedanken in Form einer Annahme (Hypothese) formulieren: Die Anziehungskraft zwischen dem Elektron und dem Atomkern geht in unmittelbarer Nähe zwischen ihnen in eine Abstoßungskraft über. Bei immer kleiner werdendem Abstand wächst die Abstoßungskraft so schnell, daß ein Zusammenstoß zwischen dem Elektron und dem Atomkern normalerweise unmöglich ist.
Diese Annahme gibt eine andere, aber immerhin eine Lösung des Problems, daß vor Rutherford gestanden hat. Das Atom kann einen gewaltigen Volumen einnehmen im Vergleich mit dem Volumen seiner Bestandteile, das Elektron muß aber dabei nicht um das Atomkern kreisen. Kann aber dieses Modell (daß in diesem Beitrag als noch weit unvollendet verstanden wird) der Wirklichkeit entsprechen?
Die Annahme regelt im Mikrobereich die Verhältnisse zwischen verschieden geladenen Teilchen: sie stoßen sich voneinander ab. Die gleich geladenen Teilchen, wie wir wissen, stoßen sich immer ab. Ein Atom mit mehreren Elektronen kann also existieren, ohne daß die Elektronen sich immer in Bewegung befinden. Das einzelne Atom mit unbeweglichen Elektronen strahlt keine Energie aus. Es ist, energetisch gesehen, stabil.
Wenn zwei verschieden geladenen Teilchen in unmittelbarer Nähe sich abstoßen und zwei gleich geladenen sich immer abstoßen, kommen wir sofort zu noch einer Folgerung, daß alle Atome in unmittelbarer Nähe sich abstoßen. (Atomen, die ein Molekül bilden, befinden sich immer noch weit genug weg voneinander.) Daraus folgt, daß alle Stoffe einem beliebig großen allseitigen gleichmäßigen Druck widerstehen können. Es ist offensichtlich, daß diese Folgerung der Wirklichkeit entspricht. Sicher, diese Folgerung ist nur ein Nebenprodukt der Annahme, es ist aber wichtig, das sie richtig ist. Diese Folgerung kann ein zusätzliches Argument zugunsten der Wirklichkeitsnähe der Annahme sein.
Das neue Modell ist nicht nur (energetisch) stabil, es ist auch ein Schwingungssystem. Wenn man das Elektron ein bißchen anstoßt, wird es aus der Gleichgewichtslage kommen. Dabei entsteht eine Kraft, die es zum Gleichgewicht zurückzubringen versucht. Darum wird das Elektron nach jeder Anregung ins Schwingen versetzt. Und dabei wird es nach Gesetzen der klassischen Physik (vor 1900) Energie ausstrahlen. Infolge dessen werden die Schwingungen immer kleiner. Das Atom kommt bald wieder zum statischen Gleichgewicht zurück. Die Tatsache, daß das Elektron bei kleinster Anregung Energie ausstrahlen kann, entspricht der Wirklichkeit. Wärmeausstrahlung wird bekanntlich schon bei sehr niedriger Temperatur registriert, als es noch sehr weit zur Lichtausstrahlung ist. (Nach dem Bohr´schen Atommodell ist das unmöglich, aber darüber, wie schon gesagt, ziemt es sich nicht zu sprechen).
Das neue Atommodell ist sehr stabil auch in dem Sinne, daß nach jeder Anregung des Elektrons (außer so großen, daß es zur Ionisierung kommt) das Atom wieder von selbst zu seinem Gleichgewicht zurückkehrt. Das Modell ist einfach, die Lage des Elektrons kann leicht berechnet werden.
Weil das Elektron und das Proton sich von weit her anziehen, in der Nähe sich aber abstoßen, können sie ein statisches Atom bilden. Das bedeutet aber nicht, daß ein zweites Proton (oder ein zweites Elektron) sich genauso dem Atom anschließen kann und dabei ein symmetrisches Bild entsteht. Ein neutrales Atom wird zwar von einem freien Proton angezogen, die Anziehungskraft ist aber unvergleichlich kleiner. Außerdem, wann die Anziehungskraft des Elektrons anfängt nachzugeben, wächst die Abstoßungskraft des gebundenen Protons immer schneller. Darum wird die Gleichgewichtslage des zweiten Protons viel weiter von dem gebundenen Elektron sein, als sein eigenes Proton. Die Gleichgewichtslage des eigenen Protons ändert sich beim Anschließen des zweiten Protons auch, aber nur unwesentlich.
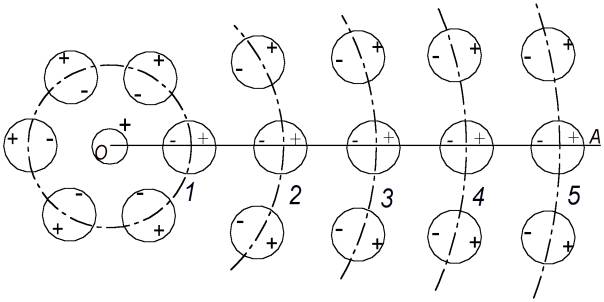
Im Bereich der Wirkung des Feldes des freien Protons kann sich noch ein neutrales Atom befinden. Wie auch das Erste wird es von ihm angezogen und in dessen Nähe eine Gleichgewichtslage finden. Aber, weil beide Atome in der Nähe sich abstoßen, wird die Gleichgewichtslage dieses Atoms symmetrisch gegenüber des Ersten an der anderen Seite des freien Protons sein. Das gleiche wird mit einem dritten, vierten und weiteren neutralen Atomen passieren, bis sich um das freie Proton eine Sphäre aus einer Schicht von neutralen Atomen bildet, die alle mit ihrem Elektron in Richtung des freien Protons „zeigen“ (Abb. 1).

Abb. 1. Das Avameiz
Damit ist aber die Anziehungskraft des freien Protons nicht erschöpft. Eine zweite Schicht von neutralen Atomen bildet sich um die erste, dann eine dritte usw..
Die Abb. 1 illustriert diese Situation. Das freie Proton (das Wasserstoffion) ist symbolisch im Zentrum in Form eines kleinen Kreises mit dem Kennzeichen (+) gezeigt. Die neutralen Atome rundherum sind in Form von größeren Kreisen gezeigt. Die Lage des Elektrons im jeden Atom ist mit (-), die Lage des gebundenen Protons mit (+) gekennzeichnet. Die zweite, dritte und weitere Schichten der neutralen Atome sind nur mit je einem Teil der Schicht aus drei Atomen dargestellt.
Weil ein Kristall die Verkörperung einer bestimmter Ordnung darstellt - und sie ist hier vorhanden, kann man sagen, daß um das Proton sich eine Art Kristall aus neutralen Wasserstoffatomen bildet.
Wie ein diskretes Strahlungs- bzw.
Absorptionsspektrum entstehen kann
Die in Abb. 1 dargestellte Ansammlung von Atomen mit einem Ion (im) Zentrum werden wir weiter der Kürze halber nach den ersten Buchstaben als Avameiz bezeichnen. Wenn wir jetzt eine Gerade durch das freie Proton ziehen (Abb. 1), werden sich auf dieser geraden Linie eine Menge von Atomen befinden, deren Abstand von dem Proton stufenweise anwächst. Geben wir den Atomen, die auf dieser geraden Linie sich befinden je eine Nummer 1, 2, 3 usw., entsprechend der Ordnungsnummer der Schicht der Atomen, beginnend mit der inneren. Entsprechend bezeichnen wir den Abstand r des Atoms bis zum Zentrum des Avameiz als ri (i = 1, 2, 3 usw.)
Jetzt führen wir einen Gedankenexperiment durch. Wir geben dem Elektron des Atoms 1 (Abb. 1), der am nächsten zu dem freien Proton ist, einen Stoß in Richtung des freien Protons. Wenn der Stoß ausreichend stark ist, wird das Elektron seinen Partner wechseln und mit dem bis jetzt freien Proton ein Wasserstoffatom bilden. Bezeichnen wir die minimale Energie, die dem Elektron für diesen Übergang notwendig war, als E1. Wenn wir das gleiche mit dem Elektron des nächsten auf der Linie Atom 2 versucht hätten, wäre die notwendige Energie ein wenig höher gewesen, weil das Atom 2 sich ein wenig weiter von dem freien Proton befindet, das Feld des Freien Protons ist hier schon schwächer und zieht das Elektron schwächer an. Bezeichnen wir diese Energie als E2 und merken uns: E2>E1. Das gleiche versuchen wir mit dem Elektron des zu dem freien Proton drittnächsten Atoms 3 und bekommen die Energie E3. Auch diese Energie wird ein wenig größer sein, als E2. Wir bekommen also auch hier: E3>E2. Aber der Unterschied zwischen diesen zwei Größen wird kleiner sein, weil das Potential des Feldes umgekehrt proportional dem Abstandsradius ist. Genauso bekommen wir aus gleichem Grunde, daß E4>E3 ist. Usw, usw. Wenn wir die Energie, die den Elektronen der weiteren Atome zugeführt werden muß, berücksichtigen, bekommen wir die Ungleichheit
|
E1<E2<E3< ... <En-1<En<En+1< ...<Ei |
(1) |
in der En desto größer ist, je größer n ist, aber alle En sind kleiner als Ei. Der Unterschied zwischen zwei benachbarten Energien in der Reihe wird immer kleiner. Ei ist die Ionisationsenergie des einzelnen Atoms, wenn keine Ionen in der Nähe sind. Für den Fall des Wasserstoffs ist Ei = 13,53 eV.
Die dargestellte Reihe En sind Absorptionsenergien. Diese Energieportionen brauchten die Elektronen, um zu dem freien Proton zu wechseln. Weil, wie man meint, das Ausstrahlungsspektrum dem Absorptionsspektrum identisch ist, kann man vermuten, daß die Energien in (1) die Energien der Lyman-Serie des Wasserstoffspektrums darstellen:
|
Em-1 = hcRy(1-1/m²) mit m = 2,3,4... |
(2) |
Hier ist h - die Planck-Konstante, c - die Lichtgeschwindigkeit, Ry - die Rydberg-Konstante.
Um die Identität mit dem Lymanspektrum rechnerisch zu belegen, müßte man die Funktion der Kraft F(r) zwischen dem Proton und dem Elektron im Mikrobereich kennen. Nach unserer Annahme sieht diese Funktion ungefähr so aus, wie in der Abb. 2 gezeigt ist. Die Anziehungskraft wächst mit der Abnahme des Abstands erst proportional dem umgekehrtem Abstandsquadrat, vermindert sich nach dem sehr schnell bis 0 (Punkt der Gleichgewichtslage, das ist Punkt 1 in der Abb. 2) und verwandelt sich dann in eine Abstoßungskraft, die wiederum sehr schnell wächst.
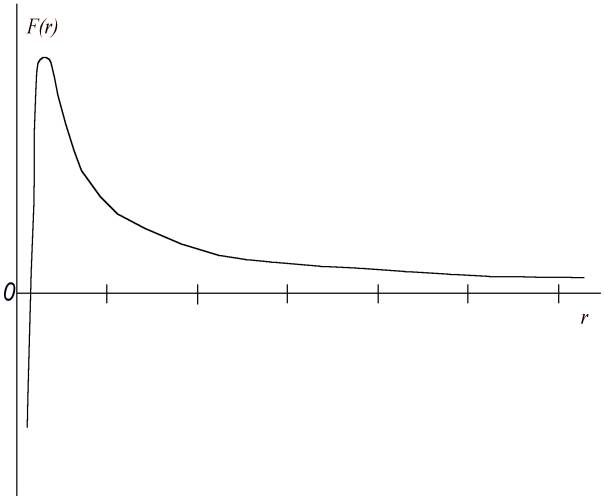
Abb. 2. Die Anziehungskraft zwischen einem Elektron und einem Atomkern verwandelt sich im Mikrobereich in eine schnell wachsende Abstoßungskraft
Die Energie, die ein Elektron im Feld des Protons bekommt, kann man nach dem Coulomb-Gesetz durch den Integral C(1/r0 - 1/r) ausdrücken, oder, was das gleiche ist, durch
|
C1(1 - r0/r) |
(3) |
Nils Bohr hat diesen Ausdruck mit dem Ausdruck für die Frequenzreihe des Wasserstoffsspektrums (2)
C2(1 - 1/n²)
verglichen und hat verstanden, daß man aus diesem folgt:
|
1/r ~ 1/n² |
(4) |
wo der Zeichen (~) „ ist proportional“ bedeutet. Wenn man jetzt statt dem laufenden r diskrete Werte rn nimmt, dann hat man sofort rn ~ n². Dieses „Ergebnis“ mußte man nachdem nur noch deuten. Bei jedem Mensch wird das „r“ mit dem Radius eines Kreises assoziiert. Die Kreisbahn des Elektrons war schon aus der Rutherford´schen Deutung seiner Experimente (in dessen Labor Nils Bohr vorher gearbeitet hat) bekannt. Bohr machte aus der beliebigen Kreisbahn von Rutherford unendlich viele „erlaubte“ Bahnen. Eine Erklärung dafür hatte er nicht. Das war keine physikalische, sondern eine mathematische Deutung.
Nils Bohr meinte, daß das charakteristische (Wasserstoff)Spektrum von den Bewegungen des Elektrons im Feld eines Protons entsteht. Darum konnte man das Entstehen von (unendlich) vielen Frequenzen des Strahlungsspektrums nur mit Hilfe eines komplizierten Atomaufbaus erklären. In Wirklichkeit bewegt sich das Elektron zwischen zwei Protonen eines Avameiz. Ein neutrales Atom aus einer Atomschicht des Avameiz (Abb. 1) „verliert“ sein Elektron, das freie Proton im Zentrum des Avameiz nimmt das Elektron an. Das ist alles. Weil die Atomschichten verschiedenen, stufenweise wachsenden Abstand zum Proton im Zentrum des Avameiz haben, wird dadurch verschiedene, stufenweise wachsende minimale Energie zur Bewirkung der Austauschionisation gebraucht. Nicht der Aufbau des Atoms, sondern der des Avameiz sorgt für die Aufteilung der Energieportionen. Rein schematisch gesehen bewegt sich das Elektron zwischen zwei Protonen (Abb. 3), von der Gleichgewichtslage in der Nähe seines Protons zur Gleichgewichtslage in der Nähe des freien Protons.
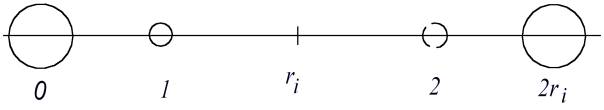
Abb. 3. Zwischen zwei Protonen hat das Elektron zwei Gleichgewichtslagen (Punkte 1 und 2)
Das Kraftfeld, in dem sich das Elektron bewegt, ist in der Abb. 4 gezeigt.
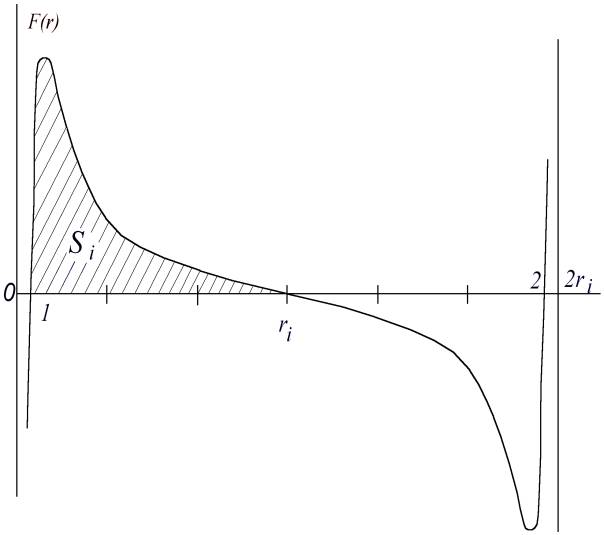
Abb. 4 Kraft, die auf das Elektron zwischen zwei Protonen wirkt. Si stellt die minimale Anstoßenergie dar, die das Elektron braucht, um zu dem freien Proton (Abb. 3) zu wechseln. Ein freies Proton befindet sich normalerweise im Zentrum eines Avameiz
In der Nähe seines Protons im Punkt 1 bekommt das Elektron einen Impuls (eine Portion Energie). Diese reicht in idealem Fall gerade dazu, daß im Punkt ri, in der Mitte zwischen den zwei Protonen, wo das Kraftfeld gleich Null ist, auch die Geschwindigkeit (praktisch) gleich Null wird. Weiter bewegt sich das Elektron in symmetrisch gleichem Kraftfeld zu dem anderen Proton, und, wenn es den Punkt 2 seiner neuen Gleichgewichtslage erreicht hat, wird es die gleiche Geschwindigkeit und die gleiche kinetische Energie haben, die es im Punkt 1 bekommen hat. Weil das Elektron kinetische Energie, also Geschwindigkeit hat, wird es im P. 2 nicht anhalten können. Aber weil von hier an die schnell wachsende Abstoßungskraft zu wirken anfängt, wird das Elektron sehr bald gestoppt und zurückgeworfen. Nach dem neuen passieren der Gleichgewichtslage wird es wieder angezogen usw.. Die Energieportion, die das Elektron im P. 2 gehabt hat, wird während der Schwingungen um den Gleichgewichtspunkt 2 ausgestrahlt. Weil 2ri dem Abstand zwischen dem freien Proton im Zentrum des Avameiz und einer Atomschicht des Avameiz entspricht, ist damit die minimale notwendige Absorptionsenergie und damit auch gleichzeitig die Energie der Ausstrahlung portioniert.
Damit wurde der mögliche physikalische Grund der Entstehung eines Strahlenspektrums dargestellt. Man könnte noch zeigen, nach welchen Formeln die Kurven in Abb. 2 und 4 gezeichnet werden müssen, damit man mindestens die Lymanserie einwandfrei darstellen kann. Wenn der Abstand zwischen den Atomschichten immer der gleiche ist, dann ändert sich die Funktion S (n) der Fläche Si in der Abb. 4 proportional dem Integral von der Funktion 1/r³.
Anstatt des Ausdrucks (3), den Bohr verwendet hat, muß man den Ausdruck für die Fläche Si (Abb. 4) verwenden
|
Sn = C3(1 - r0²/rn²) |
(5) |
Der Vergleich mit (2) liefert dann das Ergebnis: rn² ~ n², oder, was das gleiche ist:
|
r ~ n |
(6) |
Dieses Ergebnis entspricht dem Aufbau des Avameiz nach der Abb. 1. Auch hier bedeutet r einen Radius, aber nicht einer Kreisbahn, sondern den Radius einer sphärischen Schicht des Avameiz. Man kann also der Lymanserie folgen, ohne der Annahme, daß Atome kleine Planetensystemen sind (Die Natur wiederholt sich nicht).
Es wäre natürlicher zu vermuten, daß der Abstand zwischen den Atomschichten des Avameiz nicht der gleiche bleibt, daß er langsam wächst, was dann auch S(n) komplizierter machen wird. Man kann nicht vermuten, daß Avameiz unendlich viele Atomschichten haben. Paar hundert Schichten sind mehr, als ausreichend.
Hier wurde eine physikalische und kausale Erklärung für das Entstehen der diskreten Spektren in Gasen gesucht. Nur nach dem sie gefunden war, wurde gezeigt, daß sie auch mathematisch korrekt sein kann. Nichtkausale Erklärungen verwandeln sehr schnell jede Wissenschaft in eine Art Mystik. Rein mathematische Erklärungen, die eigentlich nur eine Art Anpassung, ein Ersatz für wirkliches Verstehen sind, wurden schon sehr oft verwendet. Schon bei der Berechnung der sichtbaren Lage der Planeten hat die Mathematik praktisch bewiesen, daß sie jede periodische Bewegung modellieren kann, ohne den physikalischen Grund zu verstehen. Später wurde dies auch rein theoretisch in einem schönen Theorem bewiesen. Der mathematische Weg in der Physik (wenn es nicht rein angewandte Physik ist) führt zu oft zu falschen Aussagen. Die Mathematik kann sich zu jedem Nichtverstehen anpassen und wunderbare Märchen über das noch Nichtverstandene liefern. So entstehen Zeitlöcher oder ein Schmetterling in Asien wird für ein Tornado in Amerika verantwortlich gemacht.
Man kann verstehen, daß der Beweis der Möglichkeit einen Strahlungsspektrum auf andere Weise aufzubauen das mächtige und glänzende Gebäude der Quantenphysik nicht erschüttern wird. Darum ist vielleicht viel wichtiger, daß das neue und noch nicht ausgereifte Atommodell schon einiges kann, was die Quantenphysik immer noch nicht kann. Gemeint ist die oben erwähnte Möglichkeit Energie (Wärme) bei niedriger Temperatur auszustrahlen. Das neue Model kann zusammengedrückt werden und wird dabei offensichtlich kleiner, was ganz natürlich ist. Das Bohr´sche Modell hat einen bestimmten kleinsten Radius der Umlaufbahn des Elektrons, der nicht kleiner werden kann. (Unter anderem, dieser Radius entspricht, wie man prahlt, dem des Wasserstoffs bei normalen atmosphärischen Bedingungen auf der Erde. Damit hat die Quantenphysik die Erde noch mal zum „Zentrum des Universums“ erklärt!)
Das neue Modell ist mehr der Praktik nah. Es kann sich in einem realen Gas befinden. In einem realen Gas ist das entstehen einer Avameiz mit tausend, Million oder Milliarde von Atomschichten unwahrscheinlich. Aber es ist immer mehr wahrscheinlicher, je niedriger der Druck des Gases ist. Und gerade in solchem Gas werden diskrete Spektren beobachtet. Ein Bohratom muß sich offensichtlich ganz allein im Universum befinden. Anders kann man nicht glauben, daß das Elektron eines „angeregten“ Wasserstoffatoms bei Hauptquantenzahl n = 109 immer noch brav um sein Proton kreist. Auf einer Elektronenbahn mit einem Radius von etwa 1 km! (Ein entsprechendes unwahrscheinlich großes Avameiz hätte dabei immer noch einen Radius kleiner als ein Mikrometer.)
Wichtig ist nicht das, daß eine andere Möglichkeit eine unendliche Reihe von Strahlungsfrequenzen aufzubauen gefunden ist, sondern daß sie ohne mystischen „Quantenzahlen“ aufgebaut werden kann. Wichtig ist, daß die Ausstrahlung der Energieportionen und deren Wert immer einen Grund hat, den man nicht mit neuen Annahmen unterstützen muß.
Eine neue Idee muß nicht sofort alles besser erklären können. Es ist nicht wahr, daß wenn eine Hypothese einem Fakt widerspricht, dann ist sie auch (total) falsch. Die Idee von Kopernikus erlaubte die Lage der Planeten viel weniger genau zu berechnen, als das weit entwickelte Modell nach Ptolemäos, weil auch Kopernikus meinte, daß die Planetenbahn eine Kreislinie bilden muß. Keiner hatte damals einen vernünftigen Anlas anders zu denken. Obwohl sein Modell rein rechnerisch viel ungenauer war, war es von der Sicht der Physik der Wirklichkeit viel näher. Das Modell von Bohr, auf deren Grund die Quantenphysik entstanden ist, konnte mehr als 10 Jahren überhaupt nichts erklären, außer der Strahlungsspektren selbst. Das neue Atommodell ist in diesem Sinne schon jetzt viel besser. Erklären das, was die Quantenphysik nicht erklären kann, kann auch weiter die einzige Behauptungsmethode des neuen Modells sein (in weiteren Beiträgen).
Literatur.
[1] A. Hermann, Lexikon Geschichte der Physik, Aulis Verlag Deubner & Co. KG, Köln 1987
[2] H. Vogel, Gerthsen Physik, Springer, Berlin Heidelberg 1995
[3] Hammond, Osteryoung, Crawford, Gray. Modellvorstellungen in der Chemie, Walter de Gruyter, Berlin-New York 1976
[4] N. Bohr, On the constitution of atoms and molecules, Philisophical Magazine, Vol. 26, 1913, S.1-25.