Йохан Керн, 12 июля 2003 г.
Развивается дальше новая модель атома, схематически представленная в статье [1]. Показывается, что элементарные частицы нужно представлять в форме колец, а не как обычно в форме шаров. Многие свойства атомов могут в этом случае легко моделироваться, причём и те, которые сейчас практически необъяснимы. Гораздо более наглядно объясняется понятие валентности химических элементов.
Размышления, приведённые Дмитрием Ивановичем Менделеевым (1834-1907) при представлении своей периодической системы химических элементов, сегодня, наверное, назвали бы спекулятивными. Число элементов в одном периоде до сих пор однозначно не установлено. Между первым и вторым элементом уже в первом периоде зияет огромный провал. Для тех, кто считает, что в периоде должно быть 8 элементов, второй и третий периоды заполнены, для других же и в них ещё зияет большая дыра. И это далеко ещё не все недостатки, которые можно было бы привести. Нужно быть весьма снисходительным, чтобы называть эту систему периодической. И тем не менее эта система признана во всём мире и считается весьма полезной.
Уравнения Максвелла (Maxwell (1831-1879)) были созданы при помощи весьма своеобразного метода. В наше время он встретил бы очень большие трудности при попытке опубликовать их. Его метод доказательства не признаётся и по сей день. Его соображения называют недоказанными: «Спекулятивные предположения Максвелла, приведённые им в 1864 г., сегодня относятся к признанным познаниям физики» [2]. Не все были столь привередливыми: «Элегантность уравнений Максвелла восхитила Л.Больцмана (Ludwig Boltzmann(1844-1906)). Он воскликнул: «Не был ли богом тот, кто начертал эти знаки?»» [3]. Правда, сказал он это уже после того, как Герц (Heinrich Hertz (1857-1894)) опубликовал результаты своих знаменитых экспериментов, подтверждавших предсказания Максвелла. И уравнения Максвелла сейчас признаны во всём мире, но, возможно, только благодаря экспериментам Герца, увидевшем в работах Максвелла (через 22 года после их опубликования!) открытие возможности передачи электромагнитной энергии (сигналов) на расстояние.
Соображения Николая Коперника (1473-1543), которые должны были доказать, что не Земля, а Солнце является центром Вселенной, сегодня также назвали бы не иначе, как спекулятивными. Вычисления положений планет по его системе были весьма неточными по сравнению с принятой тогда гелиоцентрической системой. Чтобы достаточно строго доказать правильность его системы понадобилось ещё более 100 лет и привлечение результатов исследований Кеплера (1571-1630) и Ньютона (1643-1727).
Здесь ниже приведены спекулятивные соображения, которые помогают представить мир атомов и молекул гораздо более наглядно и понятно. Чтобы строго доказать эти соображения с помощью неопровержимых вычислений и цифр, понадобилась бы многомесячная, если не многолетняя, работа значительного коллектива исследователей.
Сделанное в [1] предположение о том, что сила притяжения между ядром атома и
его электроном по мере достаточного сближения переходит в силу отталкивания,
позволило по иному представить атом и более правдопобно представить некоторые
физические свойства вещества. Здесь далее предпринята попытка уточнить
полученное новое представление об атомах и этим приспособить их к их известным
химическим свойствам.
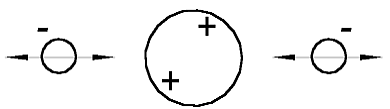
В соответствии с предположением, сделанным в [1], атом гелия должен выглядеть так, как показано на рис. 1.1. Он состоит из положительно заряженного ядра (больший шар) и двух отрицательно заряженных электронов (меньшие шары). Чисто схематически ядро гелия показано в форме большего шара, так как оно намного (примерно в 7000 раз) тяжелее электронов. Двусторонние стрелки, исходящие из центра электронов, должны показывать, что электроны могут колебаться относительно положения равновесия.

Рис. 1.1 Модель атома гелия в соответствии со статьёй [1]
Известно, что атомы гелия не вступают в химические связи с другими атомами, а также между собой. На основе же рис. 1.1 можно представить, что один из электронов атома гелия может притянуться к другому ядру другого атома гелия и таким образом (химически) свяжет оба атома (рис. 1.2).
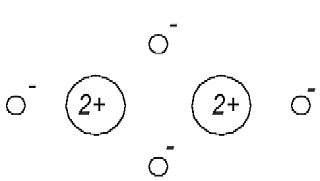
Рис. 1.2 Модель атома гелия в соответствии со статьёй [1] не является инертной
Однако подобное неизвестно. Поэтому остаётся предположить, что атом гелия выглядит как-то иначе. Разумеется, можно было бы сказать, как это утверждается в квантовой механике, что электронная оболочка гелия «вмещает только два собственных электрона» и потому не может вступить в связь с другим атомом. Но таких пустословных утверждений хотелось бы избежать. Пассивное (инертное) поведение атома гелия должно следовать из его устройства, а не из утверждений, напоминающих по форме заклинания. Этого можно достигнуть, если предположить, что электроны и ядра атомов выглядят не в форме шаров, а в виде (торообразных) колец.
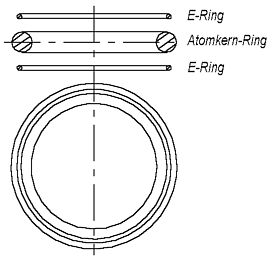
Если принять, что электрон и ядро гелия отличаются внешне только толщиной их колец, то атом гелия может выглядеть примерно так, как показано на рис. 1.3: тонкие кольца-электроны находятся на одинаковом расстоянии с обеих сторон от сравнительно толстого кольца-ядра, причём вся конструкция имеет общую вращательную ось симметрии. Многие исследователи представляют элементарные частицы в виде (вихревых) колец.
Рис. 1.3 Модель атома гелия
Примером может служить книга [4]). Рис. 1.3, разумеется, не выполнен в определённом масштабе. Если сделать толщину колец размером минимум в 1 мм, то радиус кольца электрона или ядра превысил бы размеры любой комнаты. Кольца-электроны находятся в состоянии устойчивого равновесия. При отдалении от кольца-ядра они притягиваются, а при приближении к нему – отталкиваются.
Каждый может убедиться, что представленная на рис. 1.3 модель атома гелия в большой степени химически пассивна. Это означает – она не может (химически) связаться с другим атомом или молекулой.
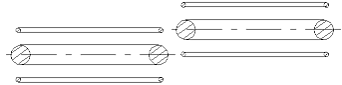
Рис. 1.4 Связь между 2-мя атомами гелия может быть только очень слабой. Сила этой
связи
находится далеко ниже уровня силы химической связи
Если попытаться привести в контакт два атома гелия в соответствии с рис. 1.4, т.е. так, чтобы поблизости друг от друга находились части колец электрона и ядра, то можно убедиться, что возникающая при этом сила притяжения между двумя атомами гелия несравнимо меньше, чем сила притяжения между ядром гелия и собственным электроном. Этой силы в лучшем случае достаточно для образования (физической) силы связи, необходимой для возможности сжижения гелия при весьма низких температурах, когда относительная скорость двух атомов весьма мала. Ниже из представления моделей других атомов можно будет видеть, что атом гелия в сравнении с другими атомами или молекулами наиболее химически пассивен. То, что в других известных представлениях моделей атомов химическую пассивность гелия можно видеть, вряд ли кто решится сказать. Там этому можно было в лучшем случае верить, исходя из того, что электронная оболочка гелия «заполнена», что означало его химическую пассивность. В то же, что оболочка «заполнена», опять-таки надо было верить. Убедиться в том, , что оболочка «заполнена», а тем более увидеть это было невозможно.
Замечание по поводу возможной согласованности кольцевой модели атомов с известными экспериментальными данными.
В [1] уже отмечалось, что Резерфорд учёл не все возможности, когда уверял,
что единственным выходом из результатов его экспериментов с альфа-частицами
является необходимость принятия гипотезы о том, что электрон вращается вокруг
ядра, но при этом не излучает энергии (в противоречие с экспериментами Герца и
выводами из уравнений Максвелла). Когда он установил, что объём электрона и
объём ядра атома весьма малы по сравнению с объёмом самого атома, он, без
обсуждения каких-либо других предположений, принял, что они имеют форму
маленьких шариков и из этих соображений провёл свои расчёты. Разумеется, он при
этом следовал давней традиции: когда мы не знаем, как нечто выглядит, мы
предполагаем, что это нечто имеет форму шарика. Наверное, в его ситуации каждый
поступил бы точно также. Надо однако заметить, что это его предположение ни в
коем случае не являлось вынужденным.
Известно, что эффективное сечение захвата электронов меняется в воздухе от
3.10-20 м² до 3.10-26 м² при изменении электрического потенциала от 300 V
до 660 kV [5]. Это означает, что при химических реакциях, лежащих в пределах
нескольких eV, считать электрон шариком с радиусом r = 1,41.10-15 м (или имеющим поперечное сечение порядка
6.10-30 м²) может оказаться совершенно неверным.
Представление же электрона в виде кольца с этой точки зрения не противоречит
реальности, а наоборот, является приближением к ней.
Медленные нейтроны имеют сечение захвата в 105 большее, чем принятое значение геометрического
сечения [6]. Т.е. и здесь медленные элементарные частицы (нейтроны) имеют
несравнимо большее сечение захвата, чем быстрые. Подобные факты не так легко
объяснить, если считать элементарные частицы имеющими форму шариков.
При представлении же их в форме колец подобные факты понять гораздо легче. В соответствии с рассматриваемой моделью альфа-частица (ядро атома гелия) является кольцом. Представим себе, что альфа-частицы вылетают из источника альфа-частиц таким образом, что плоскость их кольца всегда параллельна направлению движения. Можно себе также представить, что это кольцо очень быстро вращается вокруг оси своей вращательной симметрии, имея таким образом значительный гироскопический момент. Мы знаем, что подобное тело очень хорошо сохраняет направление своего вращения. Кольца же ядер атомов золота, находящиеся в золотой фольге, отталкивающиеся от элементов положительно заряженного кольца альфа-частицы, легче всего могут «избежать столкновения» с альфа-частицей, если они поворачивают своё кольцо параллельно пролетающему кольцу альфа-частицы, стараясь «пропустить» её. Кроме того, можно представить, что одно кольцо легко может пролететь сквозь другое таких же размеров вследствие того, что одно несколько сжимается, принимая слегка эллиптическую форму, а другое несколько растягивается, также принимая слегка эллиптическую форму, но в другом направлении. Прямое столкновение с последующим отражением альфа-частицы в этом случае может быть таким же редким, как и в том случае, если бы оба ядра были очень маленькими шариками. С другой стороны, при малой скорости частицы и соответственно малой скорости вращения кольца направление вращения кольца частицы сохраняется недолго и сечение частицы (сечение захвата) кажется нам резко выросшим на много порядков.
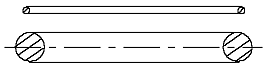
Рис. 2.1 В соответствии с рис. 1.3 атом водорода мог бы выглядеть так
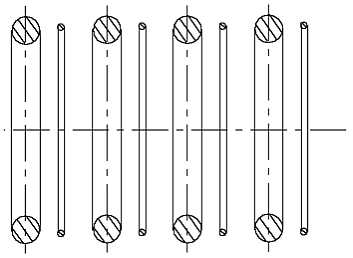
Рис. 2.2 Подобный атом водорода образовывал бы бесконечную цепь. Модель атома
неправильна
Если теперь подобным же образом представить модель атома водорода состоящей из двух колец одинакового радиуса, но различной толщины (рис. 2.1), то мы потерпим неудачу. Подобная модель атома водорода могла бы привести к группированию бесконечного ряда (химически) связанных друг с другом атомов водорода (рис. 2.2), так как соседний электрон другого атома водорода притягивался бы его ядром и наоборот. Бесконечная цепь (химически) связанных друг с другом атомов водорода неизвестна, следовательно эта модель не соответствует действительности.
Спасти идею кольцеобразных элементарных частиц, давшую нам ощутимую пассивность атома гелия, может дополнительное предположение о том, что радиус кольца ядра водорода (протона) примерно в два раза меньше, чем радиус кольца электрона.
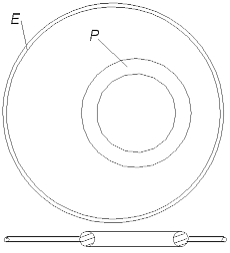
Рис. 2.3 Модель атома водорода
В этом случае модель атома водорода будет выглядеть так, как показано на рис. 2.3. Толстое маленькое кольцо ядра атома водорода – протон, находится внутри большого тонкого кольца – электрона, но не симметрично в центре, а несколько сдвинуто к периферии. Только в этом случае модель молекулы водорода становится с энергетической точки зрения правдоподобной, так как только часть кольца ядра должна связываться с частью кольца электрона. Модель молекулы водорода H2 состоит из двух толстых колец-протонов и двух тонких колец-электронов. Она может выглядеть так, как показано на рис. 2.4. Модель симметрична, все кольца находятся в положении устойчивого равновесия: при некотором отклонении любого элемента от положения равновесия возникают силы, возвращающие его в прежнее положение. Как любая молекула, модель молекулы водорода обладает определённой степенью химической пассивности, однако эта пассивность значительно меньше, чем у атома гелия.
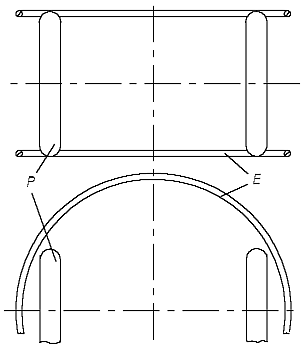
Рис. 2.4 Модель молекулы водорода H2
Как раз достаточная химическая инертность молекулы водорода ставит определённые условия к велечине радиуса кольца протона. Для того, чтобы атомы водорода не образовывали полимера (рис. 2.2) было бы достаточно, чтобы кольцо протона было настолько меньше радиуса электрона, чтобы энергетически было выгодно кольцу протона находиться в плоскости электрона. В этой ситуации модель атома водорода имела бы вращательную симметрию. Но при этом ему было бы энергетически невыгодно объединяться с другим атомом водорода, образуя молекулу водорода H2. Именно необходимость возможности образования молекулы водорода диктует ещё меньший радиус протона, при котором атом водорода становится явно несимметричным.
При подборе радиуса протона не нужно стремиться к тому, чтобы две молекулы водорода в любом возможном относительном положении отталкивались друг от друга. Более того, при правильной конструкции молекулы получить такое положение должно быть невозможным. Не надо забывать, что при достаточно низкой температуре водород должен превратиться в жидкость, а при ещё более низкой температуре – в твёрдое вещество. Для этого между двумя молекулами в определённых положениях должны наблюдаться слабые, но силы притяжения. То, что полученная молекула водорода этими качествами обладает, очевидно из рис. 2.4. Однако более подробно на этом останавливаться мы не можем. Точный расчёт молекулы водорода на данном этапе развития новой модели атомов превысил бы во много раз размеры этой статьи.
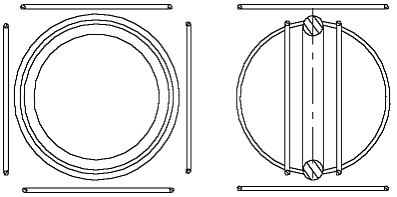
Рис. 3.1 Модель атома углерода
Шестой атом – углерод, имеет 6 электронов, из них 4 являются валентными электронами. Очевидно, можно исходить из предположения, что первые два электрона имеют анологичное положение, как у гелия. Радиус кольца ядра атома углерода также принимается равным радиусу кольца ядра атома гелия. Положение валентных электронов зависит от расстояния первых двух электронов от кольца ядра. Если первые два электрона расположены очень близко к ядру, то кольца валентных электронов могут притягиваться к ядру одной частью кольца, в противном же случае атом углерода может выглядеть так, как показано на рис. 3.1, где кольца валентных электронов расположены перпендикулярно к средней плоскости кольца ядра. Это положение валентных электронов очень удобно для представления химических свойств атома углерода (имеется ввиду, что возможно себе представить и другие положения валентных электронов).
Представленная модель атома углерода довольно сдожна. Чтобы в дальнейшем облегчить подобные графические представления, имеет смысл перейти к более простым символическим представлениям.
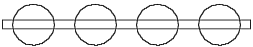
Рис. 3.2 Упрощённое (схематическое) изображение модели атома углерода
С этой целью мы мысленно рассечём кольцо ядра углерода, распрямим его и представим в виде прямого стержня.
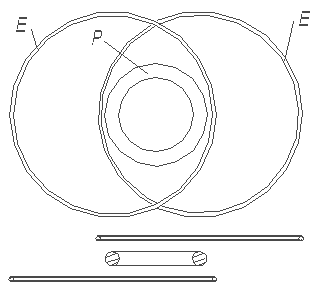
Рис. 3.3a Одиночный негативный ион водорода H-
Два электрона, расположенные параллельно кольцу ядра и не играющие роли в представлении химческих свойств, в символическом представлении вообще не будут показываться. Оставшиеся валентные электроны показываются просто в виде окружностей. В результате этой мысленной операции пространственное изображение атома углерода на рис. 3.1 преобразуется в гораздо более простое плоское символическое изображение на рис. 3.2.
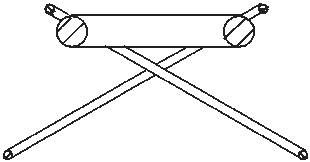
Рис. 3.3b Негативный ион водорода H- вблизи ядра (не показано) иного атома
Ввиду асимметрии (модели) атома водорода (рис. 2.3), он может довольно хорошо связываться со свободным электроном. Это соединение показано на рис. 3.3 (а и b). Оно состоит из одного протона и двух электронов. Это соединение можно обозначить знаком H-. Это отрицательный ион водорода. Он может быть показан довольно плоским (рис. 3.3а), хотя обычно в соединении с другими ядрами атомов он имеет пространственную форму (рис. 3.3b).
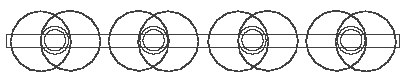
Рис. 3.4 Метан CH4. Схематическое изображение
Плоский вариант удобно применять в упрощённых символических рисунках (например, далее на рис. 3.4), а пространственный, соответственно, при показе действительного вида молекулы. Это соединение будет нами дальше часто применяться. В химии оно, повидимому, не пользуется известностью, но только по той причине, что оно всегда является составной частью молекул и свободным не встречается.
4 атома водорода связываются с 4-мя валентными электронами атома углерода (рис. 3.1 или 3.2) и образуют этим 4 соединения H-, которые, вследствие их отрицательной заряженности, притягиваются (прикрепляются) к положительно заряженному кольцу ядра углерода и этим самым образуют метан CH4. На символическом плоском рисунке метан выглядит очень просто (рис. 3.4), пространственная же его модель (рис. 3.5) сравнительно сложна. Тонкие кольца на рис. 3.5 – это электроны, маленькие толстые кольца – ядра водорода, а большое толстое кольцо – ядро углерода.
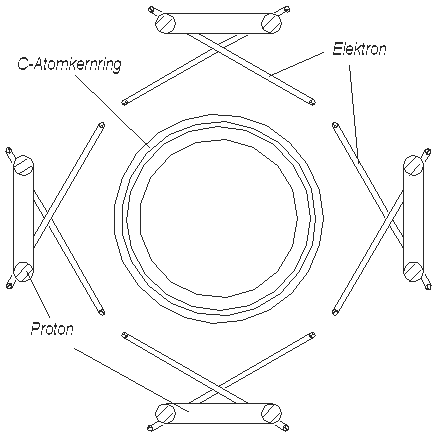
Рис. 3.5 Метан - CH4. Пространственное изображение
После построения молекулы метана CH4 уже можно себе представить, что такое валентность. Валентность переводится на русский язык словом возможность и в химии означает возможность соединения одного атома с другим. Если мы посмотрим на символическое изображение атома углерода (рис. 3.2), то увидим, что на его ядре сравнительно много свободного места, куда может притянуться часть кольца электрона. Это и есть валентность или возможность связи с другим атомом. Атом водорода в связи с его асимметрией также имеет на поверхности кольца своего ядра достаточно места, куда может притянуться часть кольца электрона. Одновременное осуществление этих возможностей может привести к образованию соединения, при котором часть своего электрона притягивается к чужому ядру и одновременно часть электрона чужого атома притягивается к собственному ядру. Таким образом, мы наблюдаем определённую аналогию «связи двух атомов при помощи двух электронов». Атом углерода имеет много свободного места на поверхности кольца своего ядра, поэтому его валентность больше единицы.
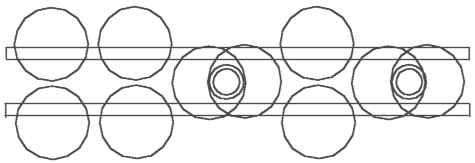
Рис. 4.1 Ацетилен - C2H2
Надо заметить, что подобное определение валентности нисколько не мешает вступлению в химическую связь и двум атомам гелия. Читатель может легко сконструировать подобную молекулу. Однако связь кольца электрона с двумя ядрами гелия несравнимо слабее, чем его связь с одним ядром. Связь двух атомов гелия на основе новой модели атома теоретически возможна, но она «энергетически невыгодна». Подобная молекула очень неустойчива. При малейшем столкновении эта молекула развалится с образованием двух атомов гелия. Другими словами, понятие валентности или возможности к вступлению в химическую связь непосредственно связано с энергетической «выгодностью» или устойчивостью этой связи. Читатель может возразить, что известны химические реакции энергетически невыгодные, с подводом энергии. Это такие реакции, где имеется локальная устойчивость, своего рода энергетические ямки, куда проваливается атом при образовании молекулы. Молекула гелия тоже возможна только благодаря наличию такой «ямки». Но эта «ямка» существует только при полной симметрии (при прямом угле между кольцами электронов и ядер) молекулы. При малейшем перекосе молекулы гелия она начинает разваливаться. Поэтому валентность атома гелия равна нулю, молекулы гелия не существуют. Однако на этом этапе развития новой модели атома мы вопрос устойчивости «энергетически невыгодных» молекул более подробно рассматривать не будем.
Число валентных электронов было только кажущимся материалистическим обоснованием валентности, в действительности это чисто мистическое обоснование. В связи с этим водород, имеющий всего один электрон, в некоторых гидридах приходится называть двухвалентным. С другой стороны, благородные газы, имеющие «заполненую» оболочку, вообще не должны вступать в реакцию, однако подобные соединения для некоторых благородных газов известны. Все эти факты вызывают необходимость «хитрых» объяснений, которым трудно поверить. Далее будет видно, что новая модель атома позволяет объяснить подобные факты без прибегания к каким-либо уловкам.
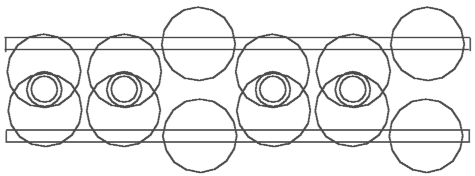
Рис. 4.2 Этилен - C2H4
Новое определение валентности позволяет в принципе любому элементу вступить в реакцию, можно ли действительно подобную реакцию наблюдать, зависит от устойчивости образуемой молекулы.
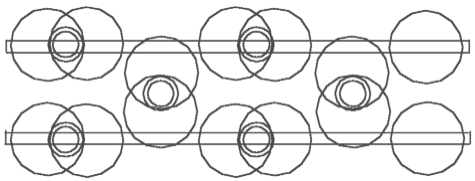
Рис. 4.3 Этан - C2H6
На основе приведённого определения валентности и уже построенных моделей можно теперь легко построить модели молекул ацетилена - C2H2 (рис.. 4.1), этилена - C2H4 (рис. 4.2) и этана - C2H6 (рис. 4.3). Посмотрим внимательней на модель ацетилена - C2H2. Мы можем утверждать, что здесь атомы водорода связывают два кольца ядра углерода. Мы имеем здесь совсем другую функцию атомов водорода. По известной структурной формуле атомы углерода привязывают к себе или связывают атомы водорода, здесь же наоборот – атомы водорода связывают (скрепляют) два ядра углерода.
После представленных моделей атомов и молекул становится ясно, что абстрактное понятие валентности должно заменить понятие о свободном месте вблизи ядра атома (для химческих элементов первых двух периодов). Если кольцо ядра атома недостаточно хорошо «экранировано» своими собственными электронами, то имеется возможность связи с другими атомами или молекулами. Это можно очень наглядно продемонстрировать следующим примером.
Валентность бора равна 3-м, валентность водорода равна 1. Поэтому должно было
бы существовать соединение BH3 или боран.
Существует же однако только B2H6 – диборан. Существование диборана в настоящее время
практически нельзя объяснить. Точнее сказать, химки вынуждены утверждать, что
водород с помощью своего единственного электрона связывается сразу с двумя
атомами бора. Разумеется, это объяснение звучит очень искуственно, потому что
сразу возникает вопрос, почему водород делает это не всегда или почему водород
ведёт себя так по разному внутри одного и того же соединения?
Мало того, при этом приходится одновременно утверждать, что 3-хвалентный бор связывается с 4-мя атомами водорода. Не означает ли это, что бор имеет здесь валентность 4, а водород – валентность 2? Подобное объяснение куда приличней назвать соглашением, соглашением со своей (научной) совестью.
(Ньютон, не зная, как объяснить дальнодействие гравитации, ответил: «Гипотез не измышляю». Сократ тоже утверждал, что не знает ничего. Но разве может себе позволить подобное современный профессор, изображающий из себя всезнайку? Сто раз опозорится глупым объяснением, но не признается в том, что современная наука – и он сам – ещё не всё знают. А ведь его признание побудило бы честолюбивого студента к поиску разумного объяснения и не внушило бы ему мысли о том, что он не может понять «умного» объяснения своего профессора.)
На основе новой модели атома можно легко объяснить существование диборана и одновременно - почему не может существовать боран. Причём без необходимости соглашений со своей совестью. Боран мог бы выглядеть так, как показано на рис. 5.1.
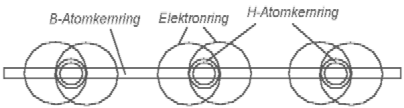
Рис. 5.1 Молекула борана - BH3 содержит 3 элемента H- с внешней стороны кольца
ядра бора. На кольце
ядра бора остаётся много свободного места, вследствие чего боран не является
химически достаточно пассивным.
На кольце ядра бора находятся три элемента Н-. Если длина кольца ядра бора не меньше, чем у гелия, то на нём остаётся ещё очень много свободного места. Способность борана к связи с другими атомами или молекулами явно не удовлетворена полностью. Можно предположить, что он может связаться с другой молекулой борана.
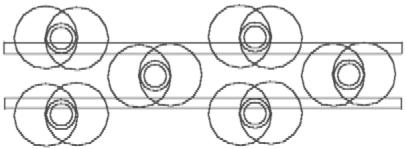
Рис. 5.2 Диборан - B2H6. На кольцах ядер бора свободных мест нет.
Рис. 5.2 показывает осуществимость этого предположения. Два кольца ядер бора связаны с помощью двух элементов Н-. 4 других Н--элемента связаны только с одним из колец ядер бора. Все свободные места на кольцах ядер бора заняты, молекула диборана в достаточной мере химически инертна. Поэтому в нормальных условиях диборан является газом.
Рис. 5.2 следует существующему предположению, что две молекулы борана связаны с помощью двух атомов водорода. Если же предположить, что все элементы Н- играют одинаковую роль в молекуле диборана, то диборан можно представить так, как показано на рис. 5.3: два кольца ядер бора связаны 6 раз с помощью 6 элементов Н-. Который из этих двух рисунков действительно соответствует диборану, можно установить на основе энергетических расчётов. Из соображений эстетики и симметрии предпочтение следует отдать рис. 5.3. На рис. 5.3 все атомы водорода ведут себя совершенно одинаково, нет никакой необходимости приписывать им различное поведение (проявление ими валентности 1 или валентности 2).
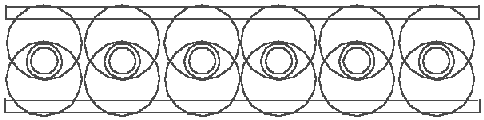
Pис. 5.3 Симметричная модель молекулы диборана
Теперь можно дать ещё одно определение валентности, хотя и эквивалентное
первому, но акцентирующее несколько иное обстоятельство, и возможно, более
ясное. Если ионизировать атом водорода, то из электрически нейтрального объекта
мы получим резко поляризированный (диполь), состоящий из двух элементов -
протона и электрона. С другой стороны, мы видим резко выраженную возможность
(валентность) к химической связи этих двух элементов. При их объединении
выделяется энергия, равная 13,53 eV. Подобная резкая поляризация означает
и резко выраженную способность (валентность) к связи двух поляризованных
элементов. Если атом рассматривать издали, то он нам, разумеется, кажется
абсолютно нейтральным. Вблизи же обнаруживаются сильные локальные поля. Но хотя
поле между кольцом электрона и кольцом ядра атома гелия очень сильное, атомы
гелия могут связываться только очень слабо, потому что расстояние между противоположно заряженными элементами колец мало. Атом водорода асимметричен, часть
кольца электрона более сильно связана с одной частью кольца ядра. Часть
элементов противоположно заряженных колец ядра и электрона находятся довольно
далеко друг от друга, поэтому чужой электрон может вступить вступить в контакт
со значительной частью кольца ядра. И наоборот, значительная часть своего
электрона может вступить вступить в контакт со значительной частью чужого ядра.
То есть, для возможности вступить в достаточно сильную (химическую) связь с
другим атомом, необходимо не только наличие различно заряженных (поляризованных)
элементов, (которые в любом атоме имеются всегда) но и достаточная их
отдалённость друг от друга. Другими словами, необходимо не только достаточно
сильное электрическое поле, но в зоне поля должна разместиться достаточно
большая часть различно поляризованных элементов другого атома. Выше это было
выражено словами – наличие свободного места. Между элементами атома гелия
существует сильное поле, но в нём может разместиться только незначительная часть
другого атома гелия. Поэтому химическая (достаточно сильная) связь между атомами или
гелия невозможна.
Можно условиться о следующем опрелелении валентности: Атом или молекула обладают химической валентностью, если на расстоянии радиуса кольца электрона от своих составных элементов они обладают достаточно сильным электрическим полем.
Можно согласиться, что это определение довольно размыто, но оно достаточно чётко выражает то обстоятельство, что химическая связь – это достаточно сильная связь атомов с помощью (собственных) статических электрических полей. С другой стороны, это определение даёт понять, что невозможно провести принципиальную границу между сильной химической связью и относительно слабой связью различных физических агрегатных состояний. Они все имеют одну и ту же природу, хотя и проявляются различно.
Приведённые примеры показывают, что атомы водорода везде делают одно и то же: они образуют элемент H- и затем связывают два кольца ядер атомов или же размещаются на одном из колец.
Структурная формула бензола C6H6 в соответствии с формальным понятием валентности
является асимметричной. Она представляет из себя плоское кольцо из 6 атомов
углерода, связанных друг с другом с помощью своих валентных электронов. Кроме
того, каждый атом углерода связан с одним из 6-и атомов водорода, расположенных
с внешней стороны бензольного кольца. Так как атом углерода имеет валентность 4,
то он может соединяться со своими соседями 4 раза: дважды с одним из соседних
атомов углерода, один раз с другим и один раз с атомом водорода. Асимметрия
состоит в том, что у атома углерода двойная связь с одним соседним атомом
углерода, но одинарная с другим. Иначе никак не получается.
«Неприятность»
состоит в том, что исследователи могут различать двойную и одинарную связь – по
длине. В бензольном же кольце связи углерода со своими соседями имеют одинаковую
длину. Это надо как-то объяснить. Сделано это было с помощью метода
резонанса. Одинарная связь воздействует на двойную (как?) и наоборот (!).
Механизм этого взаимодействия очень прост. Рядом друг с другом пишутся
две структурные формулы бензола. В одной из них двойные связи заменены
одинарными и наоборот. Эти две структурные формулы (!) якобы взаимодействуют
(резонируют) друг с другом – в результате чего обе связи
выравниваются по длине (!!!).
Кто не верит, что подобное можно с полной серьезностью написать на бумаге, может проверить сказанное по книге [5] или же прочитать это во многих других учебниках химии. С помощью словечка «резонанс» асимметрия превращается в симметрию! Как одна связь и по какой причине может воздействовать на другую, как написание рядом двух формул (!!) может вызвать (в пробирке?) резонанс - не объясняется. Это только утверждается. Повидимому, на молекулу воздействуют внушением, силой слов. Ещё более научные методы, чем этот, можно найти только в учебниках чёрной и белой магии.
Разумеется, столь «сильный» метод немедленно подхватили другие исследователи. Метод резонанса стал в химии популярен. Почти всё, что кажется непонятным, можно объяснить с помощью этого метода. Достаточно придумать различные написания одной и той же формулы – и тут же они могут вступить во взаимодействие друг с другом с последующим резонансом. На бумаге возможно всё. Бумага стерпит.
Новая модель атома позволяет построить молекулу бензола C6H6 симметричной. На рис. 6.1 между двумя линиями AB и CD показана 1/6 часть кольца бензола. Кольца ядер углерода связаны друг с другом посредством H- - элементов – с обеих сорон одинаково, т.е. симметрично. Они занимают на каждом кольце ядра углерода 1,5 электронных места, как и в случае метана (рис. 3.5), но только под другим углом к кольцу ядра углерода. Так как каждый атом углерода связан с двумя соседними, то связывающие их H- - элементы соответственно расположены с обеих сторон кольца ядра углерода. Следовательно, они занимают на каждом кольце ядра углерода 3 электрон-места. Каждое кольцо ядра углерода имеет место для 6-и электронов, но только 4 валентных электрона. Один из 4-х валентных электронов образует с атомом водорода один из 6-и H- - элементов, следовательно для оставшихся 3-х электрон-мест остаются 3 валентных электрона. Это означает, что между между двумя H- - элементами с одной стороны находятся два валентных электрона, а с другой только один (читатель далее поймёт, что вариант, когда все 3 оставшихся валентных электрона находятся с одной стороны, нет смысла рассматривать). Из этого следует, что оси симметрии H- - элементов, уже упомянутые прямые AB и CD на рис. 6.1, расположены под углом друг к другу. Однако этот угол значительно меньше 60o, следовательно, 6 раз повторённая 1/6 часть бензола в плоскости рисунка не сможет замкнуться и образовать в плоскости рисунка целое (замкнутое) кольцо. Мы получим только часть кольца. Мы знаем, что из части плоского кольца получить целое кольцо можно только на соответствующей конической поверхности. Следовательно, наше кодьцо бензола будет не плоским, а коническим.
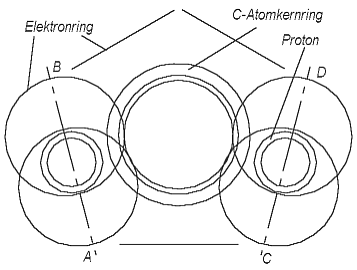
Рис. 6.1 Одна шестая кольца бензола (межде линиями AB и CD).
Новая модель атома позволяет не только строить очень наглядные модели атомов
и молекул, но и более убедительно объяснять возможность существования или
симметрию некоторых молекул. Показана принципиальная возможность на одной и той
же основе объяснять как химические, так и (некоторые) физические свойства
веществ.
Представление электронов и ядер атомов в форме колец позволяет дать
валентности новое неформальное определение, при котором исчезает принципиальное
отличие между благородными газами и другими элементами.
Примечание. Хотелось бы отметить, что после опубликования модели атома Нильса Бора на его основе более 12 лет не удавалось построить ни одной молекулы. Новая модель в самом начале своего существования позволяет объяснить некоторые свойства молекул, которые на основе модели Бора не объяснимы до сих пор. Создаётся впечатление, что новая модель атома гораздо более близка к действительности, чем признаная в настоящий момент.
Источники информации: