4.5. Бор
Паспортные данные бора: он занимает пятую позицию в таблице Менделеева и относится к третьей группе периодической системы, то есть он — уже не металл; атомная масса бора 10,811; у него известны два изотопа с атомными массами 10 и 11; плотность бора2,3 грамма в кубическом сантиметре; температура плавления 2075 градусов Цельсия; бор предстает обычно в мелкокристаллическом виде.
Очень чистый бор бесцветен, однако чистым он практически никогда не бывает и поэтому выглядит чаще всего как темно-серый, бурый или даже как черный. В физическом и, особенно, в химическом отношениях бор очень сильно похож на своего соседа — на углерод: он также соединяется с кислородом, с серой, с азотом, с фосфором, с металлами; соединяются они и между собой. Все эти соединения нуждаются в “поджоге”; при обычной же температуре бор соединяется только со фтором. С азотом и углеродом бор образует сверхтвердые нитриды и карбиды, а с водородом — гидриды, которые по аналогии с углеводородами называют еще бороводородами. Бор может участвовать также в соединениях полимеров.
В топологическом плане переход от конфигурации атома бериллия к конфигурации атома бора — ступенчатый, и поэтому, казалось бы, можно довольно точно указать, границу между их размерами; но на самом деле она не такая уж конкретная: в одном случае она может сместиться в сторону бериллия, в другом — в сторону бора, — поэтому нет смысла искать ее однозначной. Будем считать, что она пролегает где-то между 16 500 и 18 400 связанных электронов. Это — нижняя граница; верхней границы у атома бора нет: он плавно переходит в атом углерода.
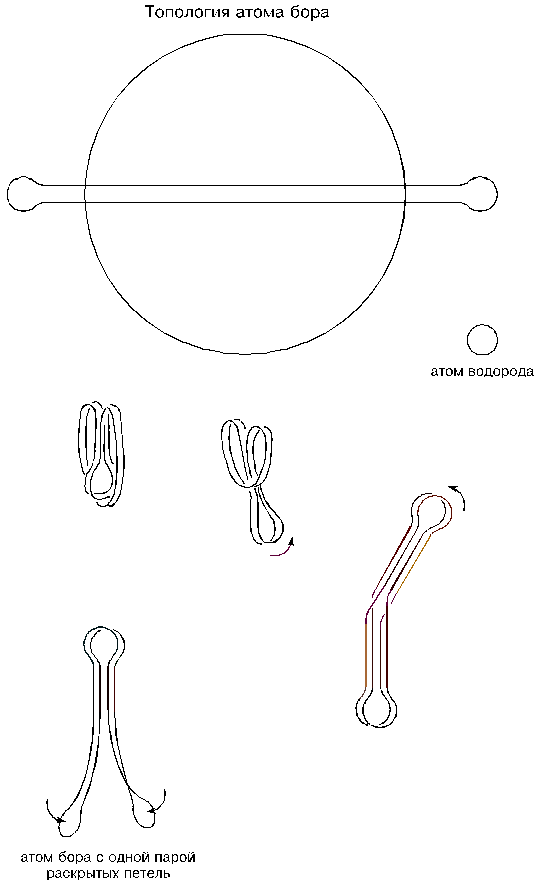
Топологию атома бора можно рассматривать как продолжение формообразования атома бериллия, но лучше начать сначала. Итак, при столкновении двух фронтов эфира могло возникнуть микрозавихрение в виде вращающейся торовой оболочки (типа дымового кольца) диаметром приблизительно в 5 900 эфирных шариков. Это кольцо из круглого превращается в овал; при самом наибольшем сплющивании, когда радиусы закруглений на его концах уменьшатся до предельных значений, то есть до 285 шариков, его длина окажется в 30 раз больше этих радиусов. Длинные стороны овала будут продолжать сближаться до полного соприкосновения, а его концевые петли завернутся, будем считать, вверх и устремятся навстречу друг другу. Столкнувшись своими вершинами, петли завернутся еще раз в том же направлении и устремятся внутрь (вниз); погонит их туда присасывание концевых петель. Завершится этот этап тем, что вершины петель упрутся в середину спаренных шнуров; точно так же формируется атом бериллия.
А дальше произойдет следующее. Спаренные шнуры, замыкающие концевые петли, также начнут слипаться между собой и вызовут удлинение атома: из формы, напоминающей яблоко, атом превратится в подобие перца. Указанное слипание спаренных шнуров теоретически должно было бы прекратиться в момент, когда вершины петель упрутся в середину шнуров, но — и в этом весь секрет — слипшиеся петли могут промахнуться и проскочить мимо или, упершись в шнуры, по случайности могут соскочить с них; и тогда слипание спаренных шнуров продолжится. Вывернувшиеся изнутри атома спаренные петли начнут разворачиваться и уходить вверх, а внизу, как следствие, возникнут уже спаренные новые, вторичные петли. Если бы длина торового шнура была достаточной (такой она будет только у атома углерода), то атом бора вытянулся бы в линию, на концах которой располагались бы перпендикулярно ориентированные между собой спаренные петли. Но атом бора еще относительно мал, и его вывернувшиеся в сторону и уходящие вверх спаренные петли замрут в каком-то полуподнятом положении, напоминающем открытый семафор, или шлагбаум, или вождя с поднятой рукой. Произойдет это потому, что вызывающему подъем петель сближению спаренных шнуров окажут сопротивление вторичные петли, исходно спаренные и не желающие размыкаться. (Все эти манипуляции становятся очевидными, если производить их на резиновом кольце.) Так образуется и так выглядит атом бора. Обратим внимание на то, что четыре шнура, соединяющие его разнесенные петли, будут выкрученными.

Охарактеризуем полученный атом бора с точки зрения его присоединительных способностей: у него — четыре петли и два присасывающих желоба; петли — попарно сомкнувшиеся, а желоба — неконтурные и с разворотом (выкрученные).
Между собой атомы бора могут соединяться только с помощью петель. Достаточно иметь повышенную температуру и (или) повышенное давление, чтобы петли атомов раскрылись и начали перекрестно соединяться между собой. Раскрытию петель способствуют выкрученные шнуры; они после такого раскрытия становятся прямыми, но одна из пар петель вынуждена при этом развернуться так, что ее присасывающие воронки оказываются снаружи, а сами петли расходятся веером.
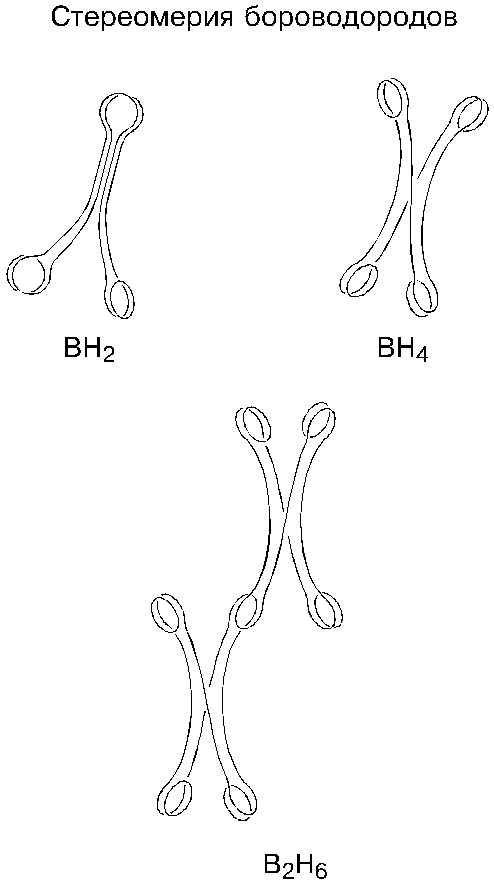 Стереометрия бора принципиально ни чем не отличается от стереометрии углерода; более того, атомы бора могут соединяться с атомами бора вперемежку, образуя хорошо известные три аллотропических модификации: пространственную, плоскостную и линейную. Атом бора может присоединить к четырем своим петлям четыре атома водорода; возможны также сложные петлевые соединения в одну молекулу нескольких атомов бора и нескольких атомов водорода в самых замысловатых комбинациях. Петлевые соединения атомы бора могут образовывать с атомами всех тех химических элементов, которые имеют также петли, то есть с неметаллами.
Стереометрия бора принципиально ни чем не отличается от стереометрии углерода; более того, атомы бора могут соединяться с атомами бора вперемежку, образуя хорошо известные три аллотропических модификации: пространственную, плоскостную и линейную. Атом бора может присоединить к четырем своим петлям четыре атома водорода; возможны также сложные петлевые соединения в одну молекулу нескольких атомов бора и нескольких атомов водорода в самых замысловатых комбинациях. Петлевые соединения атомы бора могут образовывать с атомами всех тех химических элементов, которые имеют также петли, то есть с неметаллами.
С атомами металлов атомы бора могут соединяться только с помощью присасывающих желобов; при этом его желоба вынуждены выпрямляться (избавляться от выкрученности) и раскрывать с одной стороны петли, а открытые петли, то есть петли с открытыми присасывающими воронками, ведут себя агрессивно: они готовы присосаться к первой попавшейся петле и при том даже высвобождают тепло. Соединение атомов бора с помощью желобов может осуществляться не только с атомами металлов, но и с атомами других химических элементов, у которых есть присасывающие желоба; а такие соединения могут иногда вызывать распрямление атомов бора в первоначальный длинный овал с двумя петлями на концах; такой вытянувшийся атом бора может опутывать другие атомы самым замысловатым образом.
Соединение петлями — наиболее прочное, поэтому пространственные модификации из атома бора тоже очень прочные; этому способствует еще и то, что атомы бора образуют очень простые, прямоугольные конструкции (кубические кристаллы), в которых могут отсутствовать случайные искажения — так называемые дислокации. Тепловые движения атомов поглощаются их прямыми участками и почти не затрагивают петель; отсюда — довольно высокая температура плавления. Плотность бора, определяемая расположением шнуров в межатомных соединениях, не очень высокая, но все же выше чем у бериллия, в 1,24 раза.
Идеально построенные кубические кристаллы бора имеют такую простую решетку, сквозь которую может свободно проникать свет; такие кристаллы прозрачны. Сквозь искаженные кристаллы или кристаллы с вкраплениями атомов других химических элементов свет свободно проникать не может и поглощается атомами; отдают они его уже на более низких частотах красного спектра или даже в невидимом инфракрасном диапазоне, — все зависит от собственных частот прямых участков между концевыми петлями; такие кристаллы либо бурые, либо даже черные.